監修
東北大学大学院医学系研究科
腎・膠原病・内分泌内科学分野 教授
田中 哲洋 氏
自覚症状なく進行する慢性腎臓病(CKD)。成人の8人に1人がCKDといわれています。腎臓の機能低下は不可逆性で、進行すると透析や腎移植などの腎代替療法が必要となる末期腎不全へと進展することから、いかに早期にCKDを捉えて適切な介入を行うかがポイントと言われます。6月に改訂された「CKD診療ガイドライン2023」の内容を踏まえて、CKDの全体像について東北大学教授の田中哲洋氏に解説いただきました。
CKDの定義、診断
慢性腎臓病(ChronicKidneyDisease;CKD)は単一の疾患を表す疾患名というより、「何らかの原因によって慢性的に腎臓の構造や機能が低下した状態」を指す概念です。CKDの腎障害は不可逆性で、増悪・進展すると透析や腎移植などの腎代替療法が必要となる末期腎不全へと至り生命予後とQOLに大きな影響を及ぼすことがわかりました。また、CKDは心血管疾患(CardioVascularDisease;CVD)発症やCVDによる死亡の重大なリスク因子であることが明らかになり、その発症抑制、重症化抑制の重要性が認識されました。こうしたことを背景に、CKDの疾患概念が提唱されました(表1)。
CKDは、尿検査あるいは画像検査で確認される腎障害の有無と糸球体濾過量(GlomerularFiltrationRate;GFR)による基準をもとに診断されます(表2)。
CKDの原疾患
CKDの病態を来たす原因としては、おもに生活習慣病に起因する疾患(糖尿病性腎症や高血圧性腎硬化症など)や、IgA腎症などの原発性糸球体疾患といった腎臓固有の疾患、多発性嚢胞腎を初めとする遺伝性の疾患などがあげられます(表3)。原疾患により臨床経過や予後、治療が異なってきますので、CKDの診断時には原疾患の探索を行うことが重要となります。
CKDの重症度ステージ分類
GFRと蛋白尿はそれぞれ末期腎不全、あるいは心血管疾患の独立したリスク因子であることから、CKDの重症度はそのリスクを層別化するために、原因(Cause:C)と、腎機能(GFR:G)の6区分(G1~G5)、蛋白尿(アルブミン尿:A)の3区分(A1~A3)により18段階に分けられたCGA分類で評価されます(表4)。
重症度としては、GFR区分G1/蛋白尿区分A1(表4の左上)が最も軽症、GFR区分G5/蛋白尿区分A3(表4の右下)が最重症ということになります。また、記録としては重症度を正確に把握するため、GFR区分と蛋白尿区分、原疾患がそれぞれ分かるように、例えば「CKDG3bA2(糖尿病性腎臓病)」というように記載されます。
CKDの予後と進行の特徴
腎機能は、健常者でも加齢に伴い経年的に低下していきます。また、CKDによる腎機能の障害は不可逆性のため、治療しても腎機能は回復することなく徐々に低下していきます。
CKDの進行スピードは個人差が大きく、比較的進行が緩徐で生涯ご自身の腎臓で過ごすことが可能な患者さんもいれば、進行が早いために末期腎不全に至り透析療法などの腎代替療法が必要になる患者さんもいます(図1左)。腎機能低下速度を予測する因子については多くの研究が行われています。2023年現在では、CKDの重症度分類で重視されている蛋白尿が腎機能低下の進行に最も強くに関わる因子と考えられており、蛋白尿の多い人では末期腎不全への進展リスクが高いということになります。
CKDの進行は、CGA分類で最も軽症のG1A1から最重症のG5A3に向かって徐々に移行していくというイメージですが、原疾患によってその進行のラインは異なります。原疾患別な傾向として、糖尿病性腎症では蛋白尿が増加し、その後にGFRが低下するというラインを辿りやすく、高血圧性腎硬化症ではGFRが低下した後に蛋白尿が増加するというラインを辿りやすいとされています。
CKD治療の考え方
CKDに対する治療の大きな目的は、腎機能の低下を抑制し、末期腎不全への進展を回避すること、そしてCVDのリスクを低減させCVD発症、死亡を抑制することになります。そのため、早期に治療介入を開始することで、現在の腎機能をできるだけ維持し、その後の腎機能低下のスロープを緩やかにすることが治療目標です(図1右)。
具体的な治療としては、CKD発症の原因となった原疾患に対する治療が重要なのは言うまでもありませんが、それだけでなく、原疾患に関わらずCKDの進行を抑制するための治療を行い、さらに腎臓に負担をかける病態を十分に管理して腎臓を保護することが重要です。
原疾患に対する治療
すでに腎臓病を発症している状態での治療となりますので、原疾患単独に対する治療に加えて、腎保護に主眼をおいた管理目標値の設定や、腎機能に影響の少ない薬剤選択などが求められます。代表的な原疾患に対する薬物療法に関するガイドライン掲載の主なリコメンデーションは以下のようになります。
糖尿病性腎臓病
⃝腎予後の改善とCVD発症抑制が期待されるため、SGLT2阻害薬の投与を推奨する【推奨グレード1A】
⃝顕性アルブミン尿を呈する場合、低血糖リスクが少ない症例では、細小血管合併症の発症・進展抑制のためにHbA1c7.0%未満の血糖管理を提案する【推奨グレード2C】
⃝尿アルブミンの改善を示す可能性があることから、ミネラルコルチコイド受容体拮抗薬(MRA)の使用を提案する【推奨グレード2C】
⃝体液過剰が示唆される場合には、ループ利尿薬の使用を提案する【推奨グレード2D】
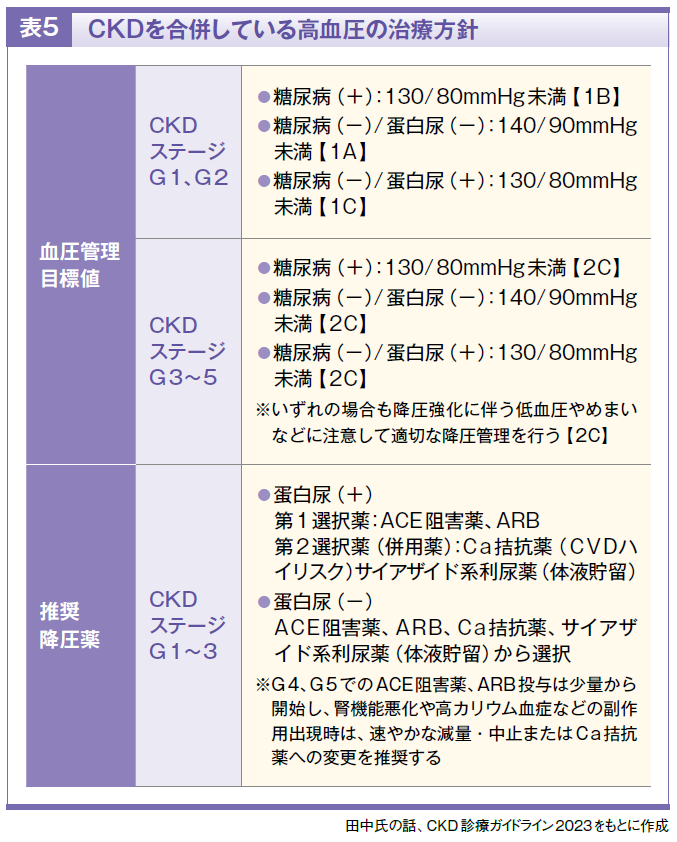
高血圧(表5)
高血圧圧性腎硬化症・腎動脈狭窄症
⃝片側性腎動脈狭窄を伴うCKDに対し、レニン・アンジオテンシン(RA)系阻害薬はその他の降圧薬に比して末期腎不全への進展および死亡リスクを抑制する可能性があり、使用することを提案する【推奨グレード2C】
⃝ただし、急性腎障害発症のリスクがあるため、少量より開始し血清クレアチニンとカリウム値を確認しつつ注意深く用量を調節する必要がある
⃝両側性腎動脈狭窄が疑われる際は、RA系阻害薬は原則として使用しない
IgA腎症
⃝RA系阻害薬はIgA腎症の末期腎不全への進展抑制、腎機能障害の進行抑制ならびに尿蛋白の減少効果を有するため使用するよう推奨する【推奨グレード1B】
⃝副腎皮質ステロイド薬は、尿蛋白1g/日以上、かつCKDステージG1、G2のIgA腎症の進行抑制並びに尿蛋白の減少効果を有するため、使用するように推奨する【推奨グレード1B】
CKDの進行を抑制するための治療(腎保護作用)
CKDの進行を抑制するための治療薬として、腎保護作用による進行抑制のエビデンスが得られているのは以下の薬剤です。
RA系阻害薬
RA系阻害薬は、古くから多く大規模臨床試験でCKDの進行を緩やかにすることが報告されており、腎臓の糸球体の輸出細動脈を相対的に拡張させ糸球体内圧を下げることで腎保護作用を発揮する。蛋白尿を低下させる作用があることから、蛋白尿を呈する患者さんでは可能な限り使用していく薬剤となっている。
SGLT2阻害薬
近年注目を浴びているのが、血糖降下薬として開発されたSGLT2阻害薬である。複数の大規模臨床試験の結果から、腎機能低下の抑制作用が報告されたことで、糖尿病合併のCKD患者さんに用いられるようになったが、現在では糖尿病非合併のCKDにも適応を持つSGLT2阻害薬も登場している。IgA腎症などその他の原疾患によるCKDについても、SGLT2阻害薬の腎保護作用が期待されており、CKD治療における基本薬としての位置づけを獲得しつつある薬剤である。
ミネラルコルチコイド受容体拮抗薬(MRA)
糖尿病性腎症に適応となっており、RA系阻害薬を用いても残された残余リスクを埋める薬剤として用いられる。
CKDの進行に伴い出現する合併症に対する治療
CKDは、進行に伴って様々な合併症が出現するため、細やかな対応が求められる。主な合併症の病態とその治療は以下のようになります。
腎性貧血
腎性貧血は、腎機能の低下に伴い、腎臓で生成される赤血球造血を促すホルモンであるエリスロポエチンの産生低下、および反応性の低下で発生する。欠乏したエリスロポエチンを補充する赤血球造血刺激因子製剤(ESA製剤)、または体内で産生を促すHIF-PH阻害薬を用いた治療が行われる。
これらの薬剤の治療効果を発揮させるため、まずは鉄欠乏状態の評価を行い、鉄欠乏が認められた場合には、適切な鉄補充療法を行う必要がある。鉄欠乏を是正した上で、ESA製剤またはHIF-PH阻害薬を用いて治療する。ESA製剤は注射剤、HIF-PH阻害薬は内服のため、両剤の使い分けとして個々の患者さんに適した剤型を選択することになる。
また、ESA治療によって到達したHb値と死亡リスク・心血管イベントリスクの関係性はU字型の相関関係を示し、Hb値が低すぎてもリスクが高くなり、逆に高すぎてもリスクが高くなることがわかっている。具体的な治療目標Hb値の上限、下限については未だ議論が続いており、最終的な結論には至っていないが、現時点では下限値は10g/dLを目安とし、上限値は13g/dL以上を目指さないこととされている。
高カリウム血症
腎機能の低下に伴い高カリウム血症が出現することがある。治療では、まず食事によるカリウム摂取量を減らす。服用中の薬剤の中に高カリウム血症を来たしやすい薬剤があれば、用量の調節や中止、他剤への変更を行う。高カリウム血症をきたしやすい薬剤としては、ACE阻害薬、ARB、アルドステロン拮抗薬、β遮断薬、強心配糖体、ヘパリン、プロスタグランジン阻害薬、筋弛緩薬、蛋白分解酵素阻害薬、カリウム含有薬などがある。それでも異常が継続する場合には、カリウム吸着薬を使ってコントロールする。
代謝性アシドーシス
CKD患者では腎機能の低下に伴い酸の排泄が低下するため、体内に酸が蓄積する代謝性アシドーシスが出現する。それに対し炭酸水素ナトリウム(重曹)の投与が行われる。代謝性アシドーシスの是正は、高カリウム血症に対しても有効である。
骨ミネラル代謝異常(CKD-MBD)
腎臓は副甲状腺ホルモンや骨細胞により分泌されるfibroblast growth factor 23(FGF 23)による調節を受けて、リンを尿中に排泄する一方、活性型ビタミンDの産生臓器として、腸管でのカルシウム・リン吸収や骨代謝の維持にも関与する。そのためCKD患者では、腎機能の低下とともにカルシウム・リン代謝、ビタミンD代謝に異常を生じる。このような状態を骨ミネラル代謝異常(CKD-MBD)と呼ぶ。
CKD-MBDでは活性型ビタミンDの血中濃度の低下と高リン血症が出現し、それにより低カルシウム血症が出現する。治療としてはリン吸着薬と活性型ビタミンD製剤が用いられる。
尿毒症
保存期の慢性腎不全の尿毒症症状に対しては、体内の毒素を吸着し便と一緒に排泄する球形吸着炭を用いて治療を行う。球形吸着炭による末期腎不全への進展、死亡といったハードエンドポイントの抑制効果は明確ではないが、腎機能低下速度を遅延させる可能性があるとされている。飲みにくさがある薬剤であるため、患者によって服用が可能であれば使用を考慮する。
早期発見、早期治療介入でCKDの進行を抑制
2021年末時点で日本の透析患者数は約35万人といわれています。近年、透析患者数の伸びは鈍化しているものの、依然として患者数は毎年増加しています。しかし、その数はCKD全体から見るとあくまでも氷山の一角に過ぎません。その予備軍であるCKD患者数全体では1,330万人、成人の8人に1人の割合でCKD患者が存在することが2005年の疫学調査で明らかになっています。
CKDは増加の一途をたどる透析患者の予備軍としてだけでなく、国民の健康に重大な影響を及ぼす心血管疾患の重大な危険因子であり、医療経済学的な側面からも、その対策が喫緊の課題となっています。CKDの進行を抑制するためには、いかに早期にCKDを捉え、早期に治療介入を行うかが非常に重要なのです。
田中 哲洋 氏 プロフィール
1997年東京大学医学部医学科卒業。三井記念病院、東京大学附属病院で腎臓病の診療に従事。2005年東京大学大学院医学系研究科修了。2006年ドイツ・エアランゲン大学腎臓内科留学。2009年東京大学保健・健康推進本部、2013年東京大学医学部附属病院腎臓・内分泌内科勤務、2015年11月より同病院講師、2020年1月より同病院准教授を経て、2022年3月より現職。所属学会:日本内科学会認定医、総合内科専門医、指導医;日本腎臓学会専門医、指導医;日本透析医学会専門医、指導医。