HIV(ヒト免疫不全ウイルス: Human Immunodeficiency Virus)感染症は、生涯にわたり服薬継続が必要な慢性疾患であり、患者の高齢化に伴い、生活習慣病など他の併用薬との相互作用の確認の重要性も高まっている。現在、専門医療機関連携薬局の追加傷病区分として議論されているHIV感染症について、現状と治療法、副作用や相互作用についてまとめた。
近年のHIV感染者/AIDS患者の動向
厚生労働省エイズ動向委員会によると、日本の新規HIV感染者数は近年ほぼ横ばいだが、AIDS(後天性免疫不全症候群; Acquired Immunodeficiency Syndrome)患者数は増加傾向にある(表1)。新型コロナウイルス感染症の流行により保健所等での検査が減少し、発症まで診断されなかった例が増えたことが一因とされる。2023年末時点の累積報告数はHIV感染者24,532件、AIDS患者10,849件、計35,381件。感染経路は同性間の性的接触が大半で、2024年速報値では新規HIV感染者/AIDS患者ともに男性が全体の9割を超える。
※集計には凝固因子製剤による感染例は含まれていない
HIV感染症の基礎知識
ARTと評価指標CD4数、血中HIV RNA量
HIVは、CD4陽性リンパ球を破壊し、細胞性免疫を障害することで、特定の感染症や悪性腫瘍のリスクを高める。HIVに感染し、数年〜10年以上続く無症候期を経て、ニューモシスチス肺炎やカンジダ症、結核といった23の指標疾患のいずれかを発症するとAIDSと診断される。
HIVの増殖を強力に抑制し、患者の免疫能を回復させる抗レトロウイルス療法(Anti-Retroviral Therapy; ART)が標準治療となり、HIV感染者の生命予後は著しく改善した。しかし、現行の抗HIV薬ではウイルス根絶は難しく、治療を中断すれば再増殖するため、生涯にわたる服薬継続が必要となる。
HIV感染症の評価には、CD4陽性Tリンパ球数(CD4数)と血中HIV RNA量が重要な指標となる。CD4数は、HIV感染症により障害をうけた患者の免疫力を反映する値で、健常者ではおおむね500〜1,000/μL程度。感染の進行に伴ってCD4数は低下し、200/μL未満になると日和見感染症※などの発症リスクが大幅に上昇する。一方、血中HIV RNA量は、血液中のHIV RNAのコピー数を示す値で、ウイルス量を反映する。血中HIV RNA量は治療効果判定において最も重要なパラメーターであり、検出限界未満(200コピー/mL未満)に抑えることが目標になる。
※宿主の感染に対する防御能が低下し、弱毒微生物、被病原微生物、平素無害菌などによって引き起こされる感染症
すべてのHIV感染者にARTが推奨 感染予防の意義も
「抗HIV治療ガイドライン(2025年3月)」(ガイドライン)では、CD4数に関わらず、すべてのHIV感染者にART開始を推奨している。また、CD4数が高い段階で早期に開始し、高いCD4数を維持しつつHIVの増殖を抑制することが長期予後に有利であるとも述べられている。
ARTは予後改善だけでなく、感染予防の意義も持つ。血中HIV RNA量を検出限界未満に持続的に抑制することで、性的パートナーへのHIV感染を防止できる。そのため、医療従事者は、「良好な服薬アドヒアランスを維持し、血中HIV RNA量を200コピー/mL未満に抑え続ければ、パートナーへのHIV感染リスクをゼロにできる(U=U; Undetectable[ウイルスが検出されない]= Untransmittable[HIVを感染させない])」と患者に伝えることも重要とされる。
抗HIV治療薬の種類と初回治療で用いられるレジメン
抗HIV薬は作用機序により6種類のクラスに分類される(表2)。
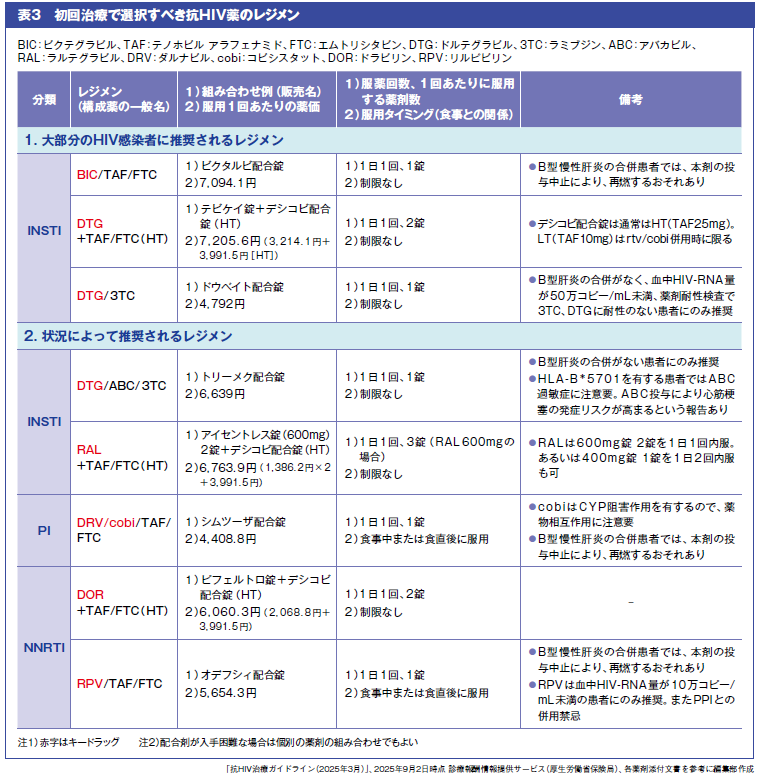
ARTは複数の抗HIV薬を用いる併用療法である。併用する抗HIV薬のなかで、HIVを強力に抑制する中心的な薬剤を「キードラッグ」、その効果を補強する薬剤を「バックボーン」と呼ぶ。キードラッグ1剤とバックボーン2剤を組み合わせる3剤併用レジメンが一般的だ。現在では配合剤が広く発売されており、実際の服用は1錠で完結する場合も多い。
薬剤選択では、長期治療を前提に、ウイルス抑制効果、安全性、併存疾患や薬物相互作用、耐性バリア、アドヒアランスへの配慮などを総合的に考慮する。ガイドラインでは、初回治療で用いる抗HIV薬の選び方について、「大部分に推奨」と「状況によって推奨」と分けてレジメンを示している(表3)。抗HIV薬の6分類のうちINSTIをキードラッグとするレジメンが主流であり、INSTIは現在のARTで中心的な役割を担っている。
ARTでの主要な存在
INSTIの副作用と相互作用を整理
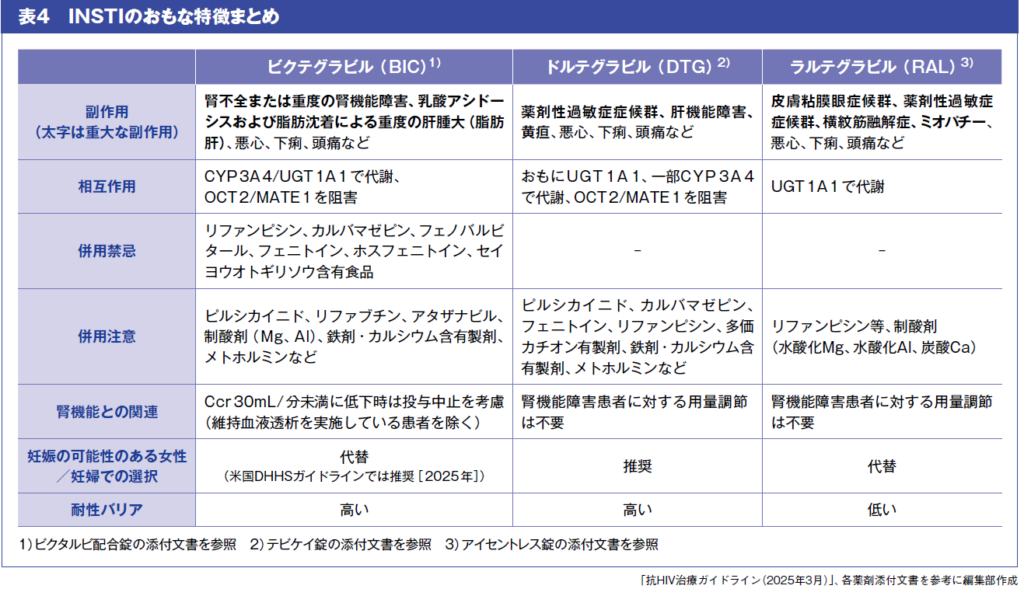
INSTI、さらに主要なレジメンで用いられるBIC・DTG・RALを中心に、副作用・相互作用について整理する(表4)。
INSTI全体に共通する特徴として、まずすべての抗HIV薬と同様に肝機能障害を起こす可能性がある。また、INSTIは、NNRTIやPIを含むレジメンよりも体重増加が大きいと指摘されている。薬物相互作用では、2価金属などの多価陽イオンとキレートを形成し、INSTIの吸収抑制を起こす可能性がある。そのため、制酸剤や鉄・Ca製剤、サプリメントなどと併用する際は、服用時間を調整する。このほか、頻度は高くないものの、精神疾患系の既往例で、鬱や自殺企図といった報告があり注意が必要とされている。
CYP3A4/UGT1A1誘導作用を持つ薬剤と併用する際は、それぞれの代謝酵素の影響によりINSTIの血中濃度が低下するため注意が必要だ。RALはおもにUGT1A1で代謝される。DTGはおもにUGT1A1で代謝され、一部はCYP3A4を介し代謝される。BICはCYP3A4とUGT1A1の両者で代謝される。こうした代謝の違いから、CYP3A4/UGT1A1を誘導するリファンピシンや抗てんかん薬(カルバマゼピン、フェニトイン等)などはRALとDTGでは併用注意、BICでは併用禁忌である。さらに、DTGやBICはOCT2/MATE1阻害作用があるため、メトホルミン併用の際にはメトホルミンの有害事象を慎重にモニターする必要がある。
稀ではあるが、重症の皮膚反応にも注意する。RALでは、スティーブンス・ジョンソン症候群や中毒性表皮壊死融解症、DTGでは薬剤性過敏症症候群が報告されている。妊娠に関しては、DTGは2018年に神経管欠損リスクが示唆されたが、その後の大規模調査で有意差は否定され、現在は妊娠希望を含め推奨薬とされる。BICも2025年に米国DHHSガイドラインで妊婦への使用が「推奨」に昇格した。RALは安全性データが豊富で妊娠期にも用いられるが、400mgの1日2回服用が推奨されている。授乳は乳汁を介した母児感染の可能性があるため、いずれの抗HIV薬も服用中は避ける。
患者の生涯にわたる服薬を支援する
生活の場に近い薬局薬剤師の視点が重要
ARTの普及によりHIV感染症は治療可能な慢性疾患となった。治療成功には患者が服薬の重要性を理解し、継続することが不可欠である。飲み忘れは薬剤耐性や治療失敗につながるため100%の服薬率が目標となる。患者が服薬を「自身とパートナーを守る行為」と認識し、定期的に受診・服薬できるよう、多職種がチームとなって支援することが重要だ。薬局薬剤師は、日常生活に近い立場で患者を支える役割を担う。服薬状況や相互作用の確認、残薬調整、感染管理指導を通して多職種と情報を共有し、連携することで、HIV治療の成功をともに支えていくことが期待されている。
【抗HIV治療と身体障害者手帳の認定基準のジレンマ】
HIVは診断後、できるだけ早期にARTを開始することが望ましい。その一方で、医療費助成に求められる身体障害者手帳(免疫機能障害)の認定基準に関する課題が指摘されている。ARTは高額のため、多くの患者が助成を受けているが、申請には「4週間以上間隔をあけた2回の検査値」が必要とされ、申請前の検査や治療費は対象外となる。さらに等級はCD4数など免疫状態や合併症、日常生活への影響で決まるが、ARTは効果が高いため、治療を始めるとウイルス量が速やかに低下し、結果的に支援の小さい等級に該当して負担が増えることもある。
早期にARTを開始した方が予後は良好だが、同時に経済的負担が増す可能性への懸念を抱える。最適な治療には、診断後速やかにHIV診療拠点病院へつなぎ、治療面と経済的背景を踏まえて検討することが重要である。薬剤師もチーム医療の一員として、課題を含めこうした制度を理解しておくことが求められる。